治疗性肿瘤细胞(ThTCs)因其可作为新抗原的天然来源正有望成为新的抗癌手段。这种方法已被证明可以触发强大的免疫反应并能够运输到肿瘤部位,从而在不同类型的癌症中诱导抗肿瘤免疫反应。一期至三期临床试验已经测试了灭活肿瘤细胞对各种类型癌症的治疗效果,包括非小细胞肺癌、结直肠癌、黑色素瘤和尤文氏肉瘤。然而,这种治疗方法显示出有限或无临床效益,这可能归因于灭活肿瘤细胞对肿瘤细胞缺乏直接的细胞毒性作用以及无法引发强烈的抗肿瘤免疫反应。
与灭活的肿瘤细胞不同,活的肿瘤细胞具有独特的靶向肿瘤的潜力。因此,工程肿瘤细胞利用其天然的新抗原来源表达治疗药物是一种合理的方式。在用于癌症治疗的各种治疗药物中,干扰素-β (IFN-β)因其直接作用(如抑制肿瘤细胞增殖和血管生成)和间接作用(如激活抗肿瘤免疫反应)备受研究者瞩目。然而,由于自分泌毒性,使肿瘤细胞稳定分泌IFN-β作为一种自我靶向的抗癌治疗受到细胞过早死亡的限制。

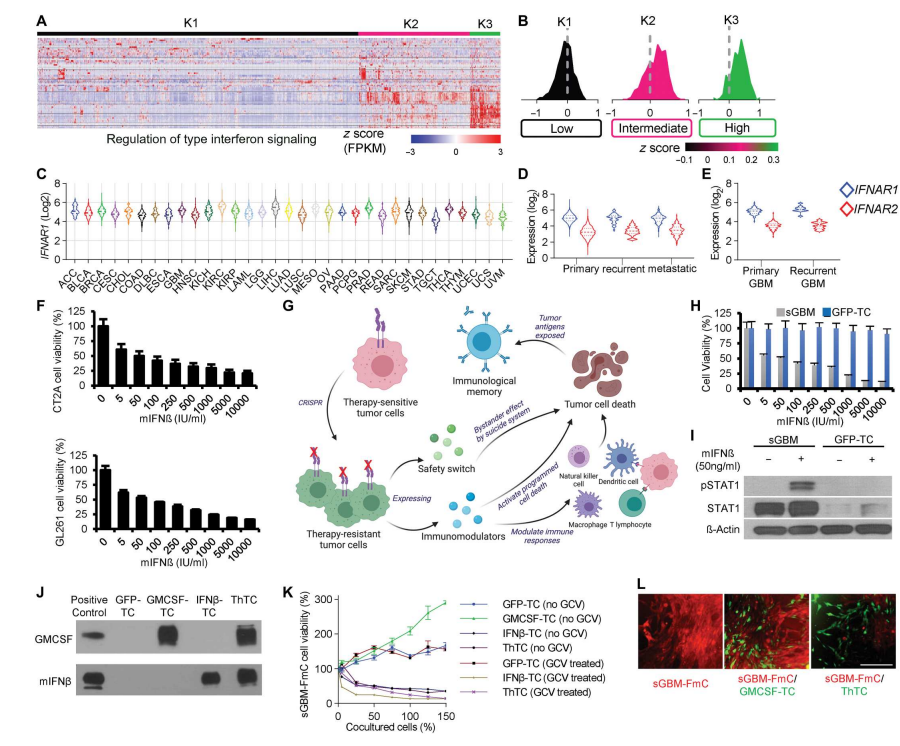
近日,美国马萨诸塞州波士顿哈佛医学院Khalid Shah教授团队开发了一种双功能治疗策略,通过将活的肿瘤细胞转化为一种有效的药物,同时驱动直接杀伤肿瘤和抗肿瘤免疫。创新性地使用CRISPR-Cas9在固有的IFN-β敏感的同基因肿瘤细胞中敲除IFN-β特异性受体(IFNAR1),随后改造它们以产生IFN-β,用于肿瘤细胞靶向和同时进行免疫调节。这些治疗细胞被进一步设计为共表达粒细胞-巨噬细胞集落刺激因子(GM-CSF),促进树突状细胞(DCs)的分化、增殖和招募。GM-CSF表达促进DCs的抗原交叉呈递、共刺激分子表达和促炎细胞因子产生的能力,从而为免疫系统的长期抗肿瘤反应做好准备。该工作以“Bifunctional cancer cell–based vaccine concomitantly drives direct tumor killing and antitumor immunity”为题发表在Science Translational Medicine期刊上。
这项研究证明了利用工程活肿瘤细胞治疗肿瘤并将免疫抑制性TME转化为免疫刺激性TME(肿瘤微环境)的治疗潜力。研究者发现ThTCs不仅能够下调细胞周期信号,而且通过下调CAF表达的PDGFRB诱导程序性细胞死亡。ThTCs还通过调节免疫细胞运输和信号转导来促进持久的抗肿瘤免疫反应。
基于研究者之前对不同同基因模型的免疫微环境的详细描述,研究团队选择了sGBM (CT2A),证明sGBM(恶性胶质瘤)是最具侵略性的sGBM同基因模型之一。
IFN-β对多种免疫细胞具有免疫刺激作用,包括肿瘤特异性T淋巴细胞、B淋巴细胞和DCs,这种细胞因子也是抗肿瘤免疫效果的决定因素。在这项研究中,研究者通过基因工程使肿瘤细胞释放一种可分泌的IFN-β的变体,从而将IFN-β现场递送到TME。与其他类型的细胞载体如间充质干细胞或髓系细胞相比,使用肿瘤细胞将IFN-β局部递送到TME有几个优点:
1.肿瘤细胞具有高度的增殖性,这为体外扩增和基因工程提供了一个容易的过程,并且在用于治疗时,肿瘤部位IFN-β的分泌时间会大大延长。
2.肿瘤细胞,特别是患者特异性的自体肿瘤细胞,是天然的新抗原来源,其可能促进抗原特异性T细胞对肿瘤的免疫。
然而,几乎所有的肿瘤细胞都表达IFNAR1/2,并且可能对IFN-β敏感。因此,分泌IFN-β的肿瘤细胞具有自分泌毒性,这在之前的研究中已被证明。
GM-CSF与ThTCs分泌IFN-β的结合进一步提高了它们的抗肿瘤作用,并诱导了长期免疫记忆,具有可加性的抗肿瘤作用。众所周知,CD8+细胞毒性T淋巴细胞在免疫治疗中具有杀伤肿瘤的作用,而CD4+ T细胞的作用和贡献则较少被重视。根据先前的研究,CD4+ T细胞能够在体内分化为T辅助1型细胞毒性T细胞,并诱导肿瘤消退,独立于CD8+ T细胞或NK细胞。文章的数据显示,与仅使用sECM和GFP-TC组相比,使用ThTCs处理的小鼠TMEs具有细胞毒性CD4+ T细胞标记物的表达升高,这些数据表明ThTCs能够激活CD4+ T细胞的细胞毒功能。另一方面,CD4+ T细胞耗竭的小鼠未能产生持久的免疫反应,从而无法对抗野生型肿瘤细胞的挑战。这意味着功能性记忆CD4+ T细胞在维持预防肿瘤生长和进展的免疫监测中起着重要作用。
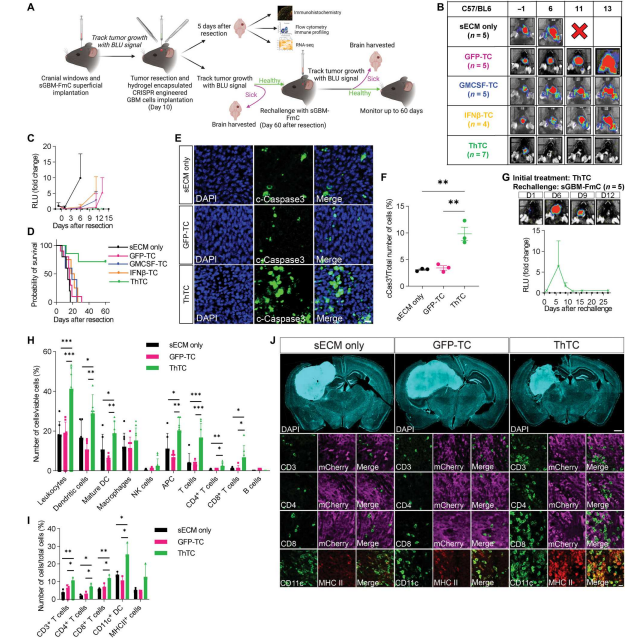
在研究团队的临床前恶性胶质瘤(GBM)切除模型中,ThTCs的引入通过激活细胞凋亡和下调PDGFRB的mRNA和蛋白水平来根除残留的肿瘤。PDGFRB是一种众所周知的GBM癌基因,可促进胶质瘤干细胞的生长、存活和侵袭。STAT1是IFN刺激的下游基因,其表达与成纤维细胞中PDGFRB的表达呈负相关,这表明间接调控IFN-β/GM-CSF的表达以防止肿瘤的生长和进展。
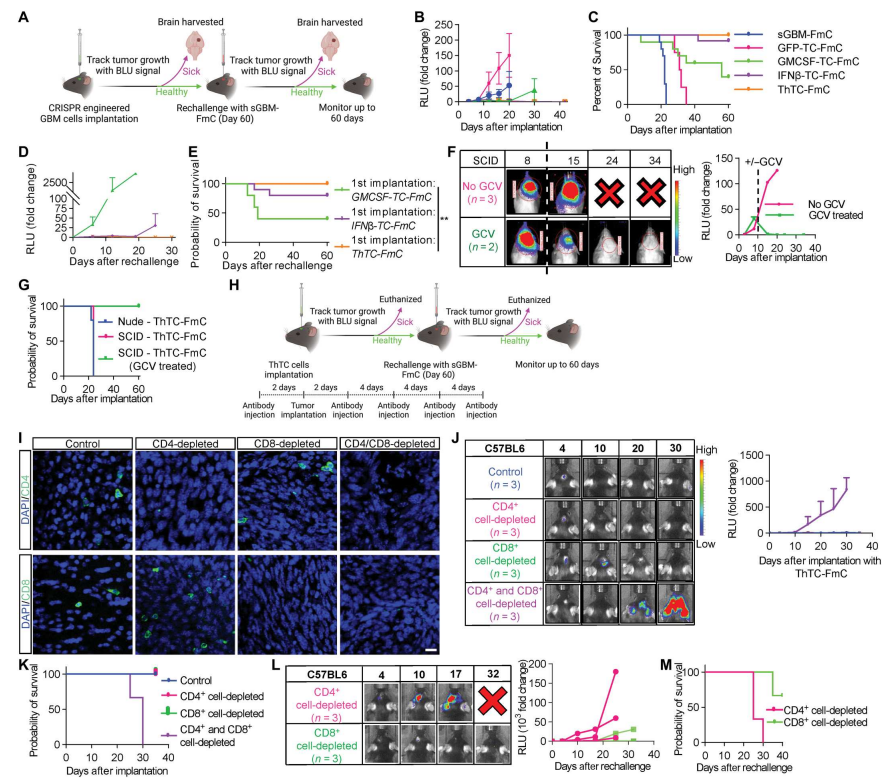
尽管研究者的ThTCs植入没有在免疫系统完整的小鼠中形成肿瘤,但研究者证明了在免疫缺陷小鼠中发生的肿瘤,这些表达单纯疱疹病毒- 1胸苷激酶(HSV-TK)的治疗性癌细胞可以在体内被更昔洛韦(GCV)治疗安全地消除,并且没有观察到肿瘤复发。研究人员观察到HSV-TK系统用于患者细胞增殖时具有很强的安全性。此外,研究者进一步在肿瘤细胞中引入了另外一个基于RapaCasp9的自杀基因,为将这些治疗性癌细胞转化为临床提供了另一层安全保障。
在体内的治疗效果不仅依赖于对肿瘤的直接细胞毒性作用,还依赖于ThTCs引起的抗肿瘤免疫反应。ThTCs的直接细胞毒性除了抑制肿瘤切除后残余肿瘤的生长和转移外,还有助于肿瘤细胞死亡后的抗原扩散。肿瘤抗原可以通过DCs递呈和交叉递呈,从而借助ThTCs分泌的IFN-β和GM-CSF激活肿瘤特异性免疫应答,促进肿瘤的根除和免疫。
总之,Khalid Shah教授团队建立了一种基于癌细胞的双功能治疗策略,可以直接靶向肿瘤细胞,间接诱导免疫介导的细胞死亡和持久免疫,以防止肿瘤复发和转移。该研究表明,将IFN-β/ GM- CSF分泌的ThTCs引入切除腔可导致转录和细胞重编程,将免疫抑制性TME转化为免疫刺激性TME。这种使用ThTCs的治疗策略显示出优秀的稳定性和广泛的适用性,有可能通过预防肿瘤进展、复发和转移来影响患者。作者设想通过这种双功能治疗癌细胞可以提供个性化的细胞治疗,并最终改善癌症患者的临床治疗结果。
